特発性間質性肺炎(指定難病85)
○ 概要
1.概要
間質性肺炎とは、胸部X線写真やCT画像にて両側びまん性の陰影を認める疾患のうち、肺の間質を炎症や線維化病変の場とする疾患の総称である。間質性肺炎の原因は多岐にわたり、職業・環境性や薬剤など原因の明らかなものや、膠原病・サルコイドーシスなどの全身性疾患に付随して発症するものとともに、原因が特定できないものが含まれる。そのうち、特発性間質性肺炎(IIPs)は原因を特定しえない間質性肺炎の総称であり、特発性肺線維症(IPF)などの9疾患に分類される。
2.原因
原因は不明である。多様な遺伝的背景に加え、環境因子の影響を受ける慢性炎症や繰り返す肺胞上皮損傷の関与が想定されている。直接の原因ではなくても間接的な影響を与える「危険因子」として最も重要なのが喫煙であり、特にIPFには喫煙者が多い。なお、明らかな原因となるような粉じん曝露はIPFの除外疾患になる。こうした危険因子を含む環境因子に過剰に反応すると思われる遺伝子多型の報告は少なくないが、明らかな遺伝性を示す間質性肺炎は家族性肺線維症として区別される。サーファクタント蛋白やその分泌機序、あるいはテロメアーゼに関わる遺伝子の異常の中に、家族性肺線維症の原因となるものが知られている。
3.症状
IIPsの中で最も頻度の高いIPFの発症は通常緩徐で、検診発見例では無症状の場合もあるが、乾性咳嗽や労作時呼吸困難を主症状とする。進行すればチアノーゼ、肺性心、末梢性浮腫などがみられる。肺以外の症状はみられない場合も多いが、体重減少、倦怠、疲労が認められることがある。また、IPFの経過中、急速に呼吸不全が進行する急性増悪を来すこともある。IPF以外のIIPsの臨床像・経過は様々で、急性・亜急性に発症するものもあるが、主症状は乾性咳嗽及び労作時呼吸困難である。なお、合併症として肺癌、肺高血圧症、気腫性病変(気腫合併肺線維症)、肺感染症(特にアスペルギルスなどの真菌)などがある。
4.治療法
IIPsに含まれる9疾患のうちIPFとIPF以外の8疾患に対しての治療方針は基本的には異なる。難治性で進行性の肺線維症であるIPFに対しては根治療法が存在せず、従来対症療法が中心であったが、最近では新しい治療の有効性が臨床試験により示されている。特にIPFの治療薬として認可された抗線維化薬pirfenidone、nintedanibは、世界的にもその効果が証明され注目されている。また、HRCT画像で蜂巣肺所見が確認されても、自覚症状もなく安定している場合には、無治療で経過観察を行うこともある。咳嗽や労作時呼吸困難などが悪化する場合には、専門医による治療が必要となる。IPF患者が急性増悪を起こした場合は、緊急入院のうえ急性呼吸窮迫症候群に準じた治療(ステロイドパルス療法など)を行う。IPF以外の間質性肺炎では診断当初から病状に応じてステロイドや免疫抑制薬を用いた治療を行う場合が多いが、最近では進行性の線維化がみられる患者にはnintedanibが有効との報告もある。
5.予後
IPFの診断確定後の平均生存期間は3~5年間と報告されている。特に、急性増悪を来たした後の平均生存期間は、2か月以内と予後不良である。また、IPF、および気腫合併肺線維症では肺癌が高率に合併することが報告されており、長期経過観察中の患者でも注意深い観察が必要である。IPF以外のIIPsでは、急性間質性肺炎(AIP)を除き一般に治療が奏効し、予後は比較的良好であることが多い。
○ 要件の判定に必要な事項
1.患者数(令和元年度医療受給者証保持者数)
15,301人
2.発病の機構
不明
3.効果的な治療方法
未確立(根治的な治療法はない。)
4.長期の療養
必要(長期経過観察が必要。)
5.診断基準
あり(日本呼吸器学会関与の診断基準)
6.重症度分類
現行の特定疾患治療研究事業のものを用い、Ⅲ度以上を対象とする。
○ 情報提供元
「びまん性肺疾患に関する調査研究班」
研究代表者 浜松医科大学内科学第二講座 教授 須田隆文
<診断基準>
下記の基準で特発性間質性肺炎と診断されたもの
Definite(組織診断群)とProbable(臨床診断群)を対象とする。
1.主要項目
(1)主要症状、理学所見及び検査所見
① 主要症状及び理学所見として、 以下の2項目以上を満たす場合に陽性とする。
1.捻髪音 (fine crackles)
2.乾性咳嗽
3.労作時呼吸困難
4.ばち指
② 血清学的検査において、以下の1項目以上を満たす場合に陽性とする。
1.KL-6上昇
2.SP-D上昇
3.SP-A上昇
③ 呼吸機能検査において、以下の1項目以上を満たす場合に陽性とする。
1.拘束性障害 (%VC<80%)
2.拡散障害 (%DLCO<80%)
3.低酸素血症 (以下のうち1項目以上)
・安静時PaO2: 80Torr未満
・安静時AaDO2: 20Torr以上
・6分間歩行時SpO2: 90%未満
④ 胸部高分解能CT (HRCT) にて、以下の1項目以上を両側性に認める場合、陽性とする。
1.網状影
2.すりガラス影
3.浸潤影(コンソリデーション)
(2)組織所見
外科的肺生検(胸腔鏡下肺生検または開胸肺生検)にて、以下のいずれかの組織パターンを認める。
1. UIPパターン
2. NSIPパターン
3. OPパターン
4. DIPパターン
5. RBパターン
6. DADパターン
7. LIPパターン
8. PPFEパターン
9. 分類不能
(3)鑑別診断
膠原病や薬剤誘起性、環境、職業性など原因の明らかな間質性肺炎や、他のびまん性肺陰影を呈する疾患を除外する(表2)。
<診断のカテゴリー>
以下のDefinite(組織診断群)、あるいはProbable(臨床診断群)の条件を満たすものを特発性間質性肺炎と診断する。
• Definite(組織診断群):(3)の鑑別診断を除外した上で、「(1)の④」と「(2)」を満たすもの。
• Probable(臨床診断群):(3)の鑑別診断を除外した上で、「(1)の①」、「(1)の②と③のいずれか」、「(1)の④」のすべてを満たすもの。
2.参考事項
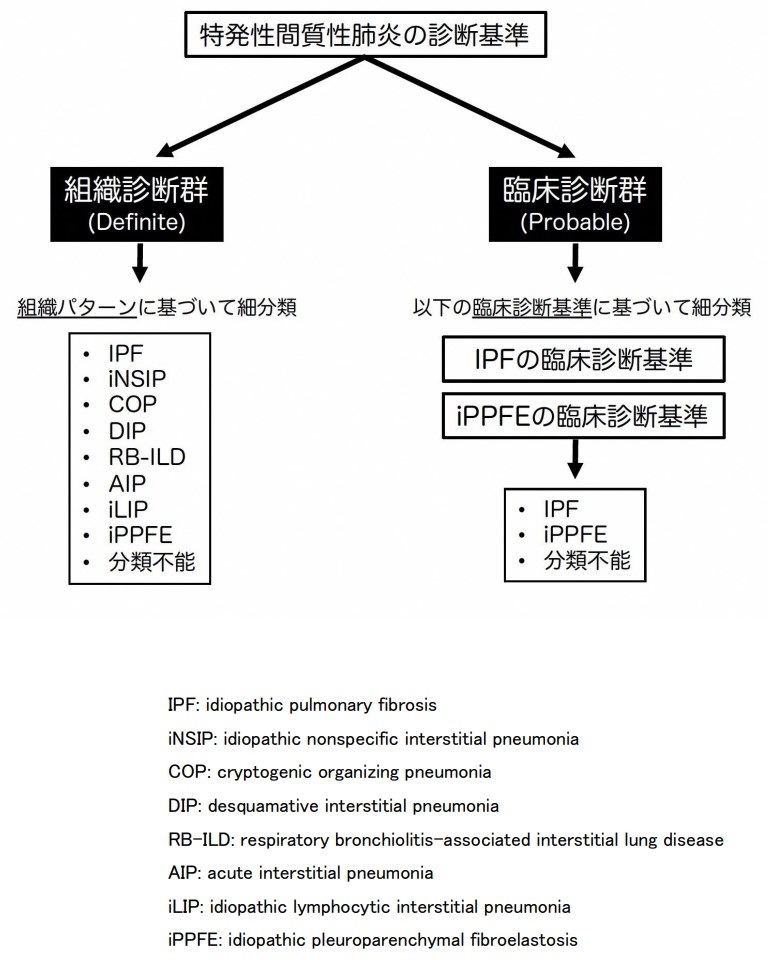
• 「Definite(組織診断群)」、「Probable(臨床診断群)」のいずれにおいても、特発性間質性肺炎と診断した後に、細分類を行う(図1)。
① 「Definite(組織診断群)」では、組織パターンに基づいて、IPF、idiopathic NSIP、COP、DIP、RB-ILD、AIP、idiopathic LIP、idiopathic PPFE、分類不能に細分類する(表1)。
② 「Probable(臨床診断群)」では、下記のIPFとiPPFEの臨床診断基準に基づいて、IPF、iPPFE、分類不能(IPFとiPPFEのいずれの臨床診断基準も満たさない)に細分類する。
• COPは経気管支肺生検(TBLB)あるいは経気管支クライオ生検(TBLC)でOPパターンを認め、臨床・画像所見がCOPに合致すれば診断可能である。
• 診断時にこれらの診断基準を満たしても、例えば膠原病など、後になって原因が明らかになった場合は、その時点で特発性間質性肺炎から除外する。
• 診断には、呼吸器専門医、胸部放射線診断医、肺病理専門医の3者による集学的検討(MDD: multidisciplinary discussion)が推奨される。
【特発性肺線維症(IPF)の臨床診断基準】
1.主要項目
① 特発間質性肺炎 (IIPs) の「Probable(臨床診断群)」の診断基準を満たす。
② 胸部高分解能CT(HRCT)所見として、以下の所見を認める。
1. 肺底部・胸膜下優位の陰影分布
2. 牽引性気管支・細気管支拡張を伴う網状影
3. 蜂巣肺
2. 診断のカテゴリー
確実:主要項目の「①」と「②の1と3」のすべてを満たすもの。
疑い:主要項目の「①」と「②の1と2」のすべてを満たすもの。
【特発性胸膜肺実質線維弾性症(idiopathic PPFE)/特発性上葉優位型肺線維症の臨床診断基準】
1.主要項目
① 特発間質性肺炎 (IIPs) の「Probable(臨床診断群)」の診断基準を満たす。
② 胸部高分解能CT(HRCT)所見として、以下の2項目を認める。
1. 両側上葉優位の胸膜直下の浸潤影(コンソリデーション)
2. 両側肺門の上方偏位、あるいは上葉の体積減少
③ 画像上、両側上肺病変の経時的な増悪が確認できる。
2.鑑別診断
造血幹細胞移植、肺移植、膠原病、薬剤などによる2次性PPFEや、画像的に類似した所見を呈する肺尖部胸膜肥厚(apical cap)、抗酸菌や真菌などの感染症。
3.診断のカテゴリー
2.の鑑別診断を除外した上で、
・ 確実:主要項目の「①」と「②」と「③」のすべてを満たすもの。
・ 疑い:主要項目の「①」と「②」を満たすもの。
4.参考事項
・ 理学所見として扁平胸郭を認める。
・ 呼吸機能検査上、残気率 (RV/TLC) の上昇を認める。
表1.特発性間質性肺炎(IIPs)の分類
|
|
|
|
|
主要なIIPs |
特発性肺線維症 (IPF) |
UIP |
|
特発性非特異性間質性肺炎 (idiopathic NSIP) |
NSIP |
|
|
呼吸細気管支炎を伴う間質性肺疾患 (RB-ILD) |
RB |
|
|
剥離性間質性肺炎 (DIP) |
DIP |
|
|
特発性器質化肺炎 (COP) |
OP |
|
|
急性間質性肺炎 (AIP) |
DAD |
|
|
まれなIIPs |
特発性リンパ球性間質性肺炎 (idiopathic LIP) |
LIP |
|
特発性胸膜肺実質線維弾性症 (idiopathic PPFE) |
PPFE |
|
|
分類不能 |
分類不能の特発性間質性肺炎 (unclassifiable IIPs) |
Unclassifiable |
IIPs: idiopathic interstitial pneumonias
IPF: idiopathic pulmonary fibrosis
RB-ILD: respiratory bronchiolitis-associated interstitial lung disease
DIP: desquamative interstitial pneumonia
COP: cryptogenic organizing pneumonia
AIP: acute interstitial pneumonia
LIP: lymphocytic interstitial pneumonia
UIP: usual interstitial pneumonia
NSIP: nonspecific interstitial pneumonia
RB: respiratory bronchiolitis
OP: organizing pneumonia
DAD: diffuse alveolar damage
PPFE: pleuroparenchymal fibroelastosis
表2.特発性間質性肺炎(IIPs)と鑑別すべき疾患
|
1. 心不全 |
略語:
HRCT:high resolution-computed tomography
BAL:bronchoalveolar lavage
TBLB:transbronchial lung biopsy
TBLC:transbronchial lung cryobiopsy
MDD:multidisciplinary discussion
図1.特発性間質性肺炎の診断フローチャート
<重症度分類>
重症度分類Ⅲ度以上を対象とする。
下記の重症度分類判定表に従い判定する。安静時動脈血酸素分圧が80Torr以上をⅠ度、70Torr以上80Torr未満をⅡ度、60Torr以上70Torr未満をⅢ度、60Torr未満をⅣ度とする。安静時動脈血酸素分圧がⅠ又はⅡ度の場合、6分間歩行時の最低SpO2が90%未満となる場合は、重症度をⅢ度とする。また、安静時動脈血酸素分圧がⅢ度の場合、6分間歩行時の最低SpO2が90%未満となる場合は、重症度をⅣ度とする。ただし、安静時動脈血酸素分圧が70Torr未満の時には、6分間歩行時SpO2は必ずしも測定する必要はない。
重症度分類判定表
|
重症度分類 |
安静時動脈血酸素分圧 |
6分間歩行時 最低SpO2 |
|
I |
80Torr 以上 |
90 %未満の場合はⅢにする |
|
Ⅲ |
60Torr 以上 70Torr 未満 |
90 %未満の場合はIVにする |
※診断基準及び重症度分類の適応における留意事項
1.病名診断に用いる臨床症状、検査所見等に関して、診断基準上に特段の規定がない場合には、いずれの時期のものを用いても差し支えない(ただし、当該疾病の経過を示す臨床症状等であって、確認可能なものに限る。)。
2.治療開始後における重症度分類については、適切な医学的管理の下で治療が行われている状態であって、直近6か月間で最も悪い状態を医師が判断することとする。
3.なお、症状の程度が上記の重症度分類等で一定以上に該当しない者であるが、高額な医療を継続することが必要なものについては、医療費助成の対象とする。
- 日本呼吸器学会 びまん性肺疾患診断・治療ガイドライン作成委員会編:特発性間質性肺炎 診断と治療の手引き2022 改訂第4版 南江堂 2022.
- 日本呼吸器学会 特発性肺線維症の治療ガイドライン作成委員会編:特発性肺線維症の治療ガイドライン 2023 改訂第2班 南江堂 2023.
- Raghu G, et al. Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosisis in Adults. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 205(9): e18-e47, 2022.
- Travis WD. et al. An Official American Thoracic Sosiety/European Respiratory Society Statement: Update of the International Multidisciplinary Classification of the Idiopathic Interstitial Pneumonias 188: 733-748, 2013.
- Natsuizaka M, et al. Am J Respir Crit Care Med. 190: 773-779, 2014.
治験を実施している指定難病を調べることができます。キーワード検索欄に指定難病名を入力し、検索してください。
治験・臨床研究情報検索サイト一覧
| 研究班名 | びまん性肺疾患に関する調査研究班 研究班名簿 |
|---|---|
| 情報更新日 | 令和6年4月(名簿更新:令和7年6月) |
