IgA腎症(指定難病66)
○ 概要
1.概要
慢性糸球体腎炎のうち、糸球体メサンギウム細胞と基質の増殖性変化とメサンギウム領域へのIgAを主体とする沈着物とを認めるものをいう。同義語としてIgA腎炎、ベルジェ(Berger)病などがある。慢性糸球体腎炎の一病型として確立しているが、日本においては1970年代初期から活発な研究が行われ、慢性糸球体腎炎のうち成人では30%以上、小児でも20%以上を占めていることが明らかになった。日本と同じように本症が多発する国としては、アジア太平洋地域の諸国が知られており、北欧や北米では比較的少ない。このような地域差の原因は不明であり、一部では腎生検施行の頻度と比例するともいわれ、北米においては白人には多いが、黒人ではまれであることも知られているため、何らかの人種的・遺伝的背景も想定されている。成人・小児共に男性にやや多く、発見時の年齢は成人では20歳代、小児では10歳代が多いが、患者層は全ての年齢にわたっている。
2.原因
本症は、流血中の糖鎖修飾異常IgAならびにそれに関連した免疫複合体の糸球体内沈着によって引き起こされるとする説が最も有カである。その根拠は、糸球体内に糖鎖修飾異常IgAが沈着していることや、そこにIgGが共沈着し、C3などの補体成分沈着も認めること、移植時にIgA腎症が再発する場合、糸球体に短期間のうちに高率にIgAの沈着を認めること、逆に少数報告ではあるが本症に罹患した腎臓を他の疾患患者に移植すると糸球体内IgA沈着が消失することなどである。最近では、遺伝的素因粘膜免疫の異常等が本症の病態との関係で研究が進展しつつある。しかし、免疫複合体を形成している抗原の同定は未だ十分には成功していないが、糖鎖異常IgA自体が免疫複合体形成の原因となっている可能性がある。その他、糸球体硬化に至る本症の進展については本症以外の多くの糸球体疾患と共通した機序が存在することが明らかになりつつある。
3.症状
本症発見時の症状は、日本では偶然の機会に蛋白尿・血尿が発見されるものが大多数を占めるが、諸外国ではこの比率が低く、肉眼的血尿や浮腫などの症候性所見の比率が本邦よりも高い。この差異は、日本では検尿が発達していることや、腎生検施行対象症例の選択方針が内外で異なるためと考えられており、ヨーロッパ諸国の中でも腎生検を比較的活発に行っている地域では本症の発現頻度が高いこととともに、無症候性蛋白尿・血尿の比率が高くなっている。
4.治療法
本症の治療については根本的な治療法が得られていないために、対症療法が行われている。レニンアンギオテンシン系阻害薬、副腎皮質ステロイド薬(パルス療法を含む。)、免疫抑制薬、口蓋扁桃摘出術(+ステロイドパルス併用療法)などで治療を行う。進行抑制を目的とした成人IgA腎症の治療の適応は、腎機能と尿蛋白に加えて、年齢や腎病理組織像も含めて総合的に判断される。また、症例に即して血圧管理、減塩、脂質管理、血糖管理、体重管理、禁煙などを行う。
5.予後
診断時の腎機能や症状により予後が異なる。成人発症のIgA腎症では10年間で透析や移植が必要な末期腎不全に至る確率は15~20%、20年間で約40%弱である。降圧薬(特にレニンアンギオテンシン系阻害薬)や副腎皮質ステロイド薬の積極的な使用により、1996年以降、予後が改善しているとの報告もある。また、小児では、成人よりも腎予後は良好である。予後判定については、腎生検光顕標本における組織障害度が重要であるということは異論がなく、その他の臨床指標の中で腎生検時の高血圧、腎機能低下、高度蛋白尿、患者の高年齢などが予後判定上有用であることも共通した認識である。
○ 要件の判定に必要な事項
1.患者数(令和元年度医療受給者証保持者数)
10,074人
2.発病の機構
不明(糖鎖異常IgA免疫複合体の関与が指摘されている。)
3.効果的な治療方法
未確立(対症療法が中心)
4.長期の療養
必要(腎生検後10年で15~20%、20年間で38%前後が末期腎不全に陥る。)
5.診断基準
あり(日本腎臓学会承認の診断基準等)
6.重症度分類
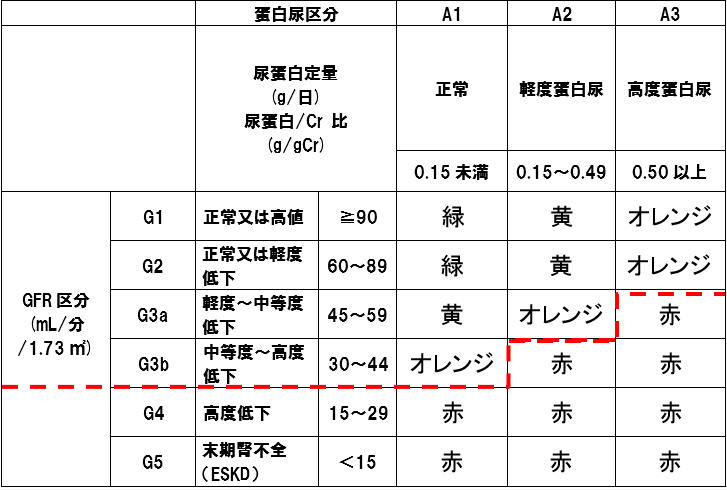
研究班による重症度基準に基づき、A.CKD重症度分類ヒートマップが赤の部分の場合、B.蛋白尿0.5g/gCr以上の場合、C.腎生検施行例の組織学的重症度III若しくはIVの場合のいずれかを満たす場合を対象とする。
○ 情報提供元
「進行性腎障害に関する調査研究班」
研究代表者 新潟大学医歯学総合研究科 腎・膠原病内科学 教授 成田一衛
<診断基準>
IgA腎症の診断基準
1.臨床症状
大部分の症例は無症候であるが、ときに急性腎炎様の症状(肉眼的血尿など)を呈することもある。ネフローゼ症候群の発現は比較的まれである。
一般に経過は緩慢であるが、10年で15~20%、20年の経過で約40%の患者が末期腎不全に移行する。腎機能が低下した例では、腎不全の合併症(高血圧、電解質異常、骨ミネラル異常、貧血など)が見られる。
2.尿検査成績
尿異常の診断には3回以上の検尿を必要とし、そのうち2回以上は一般の尿定性試験に加えて尿沈渣の分析も行う。
A.必発所見:持続的顕微鏡的血尿 注1)
B.頻発所見:間欠的又は持続的蛋白尿
C.偶発所見:肉眼的血尿 注2)
3.血液検査成績
A.必発所見:なし
B.頻発所見:成人の場合、血清IgA値315mg/dL以上 注3)
4.確定診断
腎生検による糸球体の観察が唯一の方法である。
A.光顕所見:巣状分節性からびまん性全節性(球状)までのメサンギウム増殖性変化が主体であるが、半月体、分節性硬化、全節性硬化など多彩な病変が見られる。
B.蛍光抗体法または酵素抗体法所見:びまん性にメサンギウム領域を主体とするIgAの顆粒状沈着 注 4)
C.電顕所見:メサンギウム基質内、特にパラメサンギウム領域を中心とする高電子密度物質の沈着
[付記事項]
1.上記の2-A、2-B、および3-Bの3つの所見が認められれば、本症の可能性が高く、確定診断に向けた検討を行う。ただし、泌尿器科的疾患の鑑別診断を行うことが必要である。
2.本症と類似の腎生検組織所見を示しうる紫斑病性腎炎、肝硬変症、ループス腎炎などとは、各疾患に特有の全身症状の有無や検査所見によって鑑別を行う。
3.本症の腎生検病理組織所見において必須の所見は、B.蛍光抗体または酵素抗体法所見であり、A.光顕所見、C.電顕所見は必須ではないが正確な診断に寄与する(例えばBの検体試料が不十分で評価できないなどの場合にメサンギウム領域の免疫沈着物を観察するなど)。3項目すべて揃う必要はない。
注1)尿沈渣で、赤血球5~6/HPF以上
注2)急性上気道炎あるいは急性消化管感染症後に併発することが多い。
注3)全症例の半数以上に認められる。(標準血清を用いた多施設共同研究による。)
注4)他の免疫グロブリンと比較して、IgAが優位である。
<重症度分類>
以下のいずれかを満たす場合を対象とする。
A.CKD重症度分類ヒートマップが赤の部分の場合
B.蛋白尿0.5g/gCr以上の場合
C.腎生検施行例の組織学的重症度III又はIVの場合
CKD重症度分類ヒートマップ
※診断基準及び重症度分類の適応における留意事項
1.病名診断に用いる臨床症状、検査所見等に関して、診断基準上に特段の規定がない場合には、いずれの時期のものを用いても差し支えない(ただし、当該疾病の経過を示す臨床症状等であって、確認可能なものに限る。)。
2.治療開始後における重症度分類については、適切な医学的管理の下で治療が行われている状態であって、直近6か月間で最も悪い状態を医師が判断することとする。
3.なお、症状の程度が上記の重症度分類等で一定以上に該当しない者であるが、高額な医療を継続することが必要なものについては、医療費助成の対象とする。
- エビデンスに基づくIgA腎症診療ガイドライン2020
https://jsn.or.jp/academicinfo/report/evidence_IgA_guideline2020.pdf - エビデンスに基づくCKD診療ガイドライン2023
https://cdn.jsn.or.jp/medic/guideline/pdf/guide/viewer.html?file=001-294.pdf - KDIGO Guidelines:GLOMERULAR DISEASES (GD)
https://kdigo.org/guidelines/gd/
| 研究班名 | 難治性腎障害に関する調査研究班 研究班名簿 研究班ホームページ |
|---|---|
| 情報更新日 | 令和7年10月(名簿更新:令和7年10月) |
治験を実施している指定難病を調べることができます。キーワード検索欄に指定難病名を入力し、検索してください。
治験・臨床研究情報検索サイト一覧
